世界で初めてヘム鉄代謝の鍵となる電子伝達複合体の立体構造を解明
平成26年2月4日
久留米大学
世界で初めてヘム鉄代謝の鍵となる電子伝達複合体の立体構造を解明
概要
久留米大学医学部医学科の杉島正一准教授、野口正人教授らは、ラット由来NADPH-シトクロムP450還元酵素(CPR)がCPRから電子を受け取るタンパク質の一つであるヘムオキシゲナーゼ(HO)と結合した状態(電子伝達複合体)の立体構造を、世界で初めて決定しました。構造解析にあたっては、大型放射光施設SPring-8やSAGA-LSの放射光を利用しました。この構造解析の結果、CPRが電子の受け取り手をどのように認識して、HOやシトクロムP450などの酵素反応に必要な電子をどのように受け渡すのかというメカニズムが明らかになりました。この成果は副腎酵素欠損症(特定疾患)の一つであるAntley–Bixler syndromeに対する薬剤、コレステロールやステロイドホルモンの代謝に関係する病気に対する薬剤、抗がん剤開発への貢献が期待されます。
本研究成果は、国際学術雑誌「Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)」に掲載される予定です。出版に先立ってオンライン版が2月3日(月)(東部標準時)以降一週間以内にインターネット上で公開されます。
背景
ヘムは酵素やタンパク質が機能するために必要な物質の一つで、ヘモグロビン中では酸素運搬、シトクロム類では電子伝達、ペルオキシダーゼやシトクロムP450では酸素や過酸化水素を活性化する補酵素として機能しています。ヘムは主に赤血球の新陳代謝にともなって、脾臓や肝臓で日々分解されていますが、その役割を担う酵素がヘムオキシゲナーゼ(HO)です。ヘム分解の生理的な役割は、不要なヘムの分解だけではなくて、1)ヘムから鉄を取り出し再利用すること、2)酸化ストレスに対する防御、3)抗炎症や抗アポトーシスなどに関与する微量の一酸化炭素の生成の3種類と考えられています。特に3)の役割は発がん機構とも関連するので、HOは抗がん剤の標的としても考えられています。
HOがヘムを分解する酵素反応を行うためには電子の供給が必要で、これを供給するのがNADPH-シトクロムP450還元酵素(CPR)です。HOとCPRそれぞれの立体構造はX線結晶構造解析(*1)により解明されていましたが、HOなどのCPRから電子を受け取るタンパク質とCPRとの複合体の立体構造は不明でした。特にCPRはその状態によって、立体構造が大きく変化することが知られており、HOやそれ以外の電子を受け取るタンパク質をどのように認識して、電子を受け渡すのかは不明でした。
内容
HOとCPRが結合した状態の立体構造を大型放射光施設SPring-8の放射光を利用したX線結晶構造解析により明らかにしました(図1)。また、この複合体の立体構造が溶液中でもほぼ同様であることを、放射光施設SAGA-LSの放射光を利用したX線小角散乱(*2)により明らかにしました。
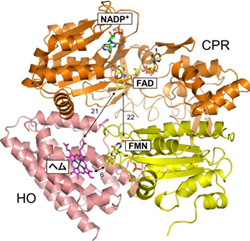
【図1 CPRとHOの電子伝達複合体構造】
オレンジ(FAD結合ドメイン)と黄色(FMN結合ドメイン)はCPRの、ピンクはHOの立体構造をリボン図で示している。数字は距離をÅ単位で示している。
X線結晶構造解析の結果、CPRは”open”と呼ばれる形でHOと結合していました。”open”ではCPRに含まれるFMNがCPRの外側に露出しています。CPRは補酵素としてFADとFMN(*3)を1分子ずつ結合しています。一般的にNADPH→FAD→FMN→ヘムの順序で電子が受け渡されると考えられています。CPRとHOの複合体中ではFMNとヘムが6Å(*4)程度の距離にあり、FMNからヘムへの電子伝達はスムーズに進むと考えられました。しかしFADとFMNの間は20Å以上離れており、この形のままではFADからFMNへの電子伝達は困難です。
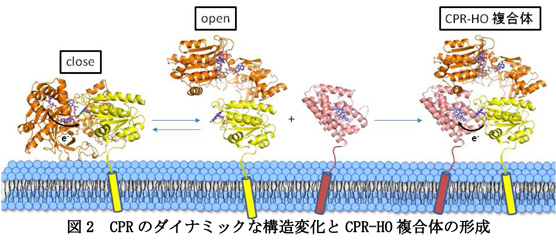
従って、FADからFMNへの電子伝達時には”close”と呼ばれる形へのCPRのダイナミックな構造変化が生じて、NADPHからFMNへと電子を受け渡すと考えられます(図2)。この構造変化によって、HOはCPRと立体的に衝突するので、CPRから電子を受け取った後にCPRから解離すると考えられました。このようなCPRの構造変化を伴う電子伝達反応はHOとの場合だけではなく、シトクロムP450との電子伝達反応においても同様と考えられ、研究成果の波及効果が大きいことが期待されます。
今後の展開
HOはヘム鉄代謝に深く関与しますが、その過程で出てくる一酸化炭素はがん細胞を保護する効果があると示唆されており、HOの適切な阻害による抗がん剤開発が期待されています。また、シトクロムP450は薬物、ステロイドホルモンやコレステロールの代謝に関与し、CPRの変異が原因の遺伝病としてステロイドホルモンの産生異常を示すAntley–Bixler syndromeが知られています。本研究で得られたCPRとHOの電子伝達複合体の立体構造は、CPRとHOやシトクロムP450との相互作用を阻害もしくは増強する薬剤開発の構造基盤として、Antley–Bixler syndromeに対する薬剤、コレステロール代謝やステロイドホルモンに関係する病気に対する薬剤、抗がん剤の開発に対する貢献が期待されます。
なお、本研究は文科省科研費(若手(B)20770092, 24750169, 25840026, 基盤(C)21590321, 24590366)および石橋学術振興基金助成金による支援のもと、実施されました。
共同研究グループ
久留米大学:野口正人教授、杉島正一准教授、佐藤秀明准教授、東元祐一郎准教授、原田二朗講師
宮崎大学:和田啓助教
大阪大学:福山恵一名誉教授
用語解説
*1 X線結晶構造解析
タンパク質の分子の形(立体構造)を詳細に決定する実験方法。対象となるタンパク質の単結晶を作成し X 線を照射することによって、精密な立体構造を決定することができる。今回の成果は、大型放射光施設SPring-8 生体超分子構造解析ビームラインBL44XUを利用することで得られた。
*2 X線小角散乱
大まかなタンパク質の構造情報を取得する実験方法。X線結晶構造解析と違って、溶液状態でも立体構造情報を得ることができる。今回の成果は、放射光施設SAGA-LS 局所構造ビームラインBL11を利用することで得られた。
*3 FAD, FMN
フラビン環を含む補酵素。ビタミンB2(リボフラビン)から生合成される。生体内では電子伝達反応や青色光受容に用いられる。
*4 Å
距離の単位。1Åは10-10 m (0.1 nm)。
論文
Masakazu Sugishima, Hideaki Sato, Yuichiro Higashimoto, Jiro Harada, Kei Wada, Keiichi Fukuyama, and Masato Noguchi,
Structural basis for the electron transfer from an open form of NADPH–cytochrome P450 oxidoreductase to heme oxygenase,
Proceedings of the National Academy of Sciences of the United States of America, in press.
お問合せ先
研究に関するお問い合わせ先
久留米大学医学部医学科 准教授
杉島 正一 (すぎしま まさかず)
TEL: 0942-31-7544, FAX: 0942-31-4377
Mail: sugishima_masakazu@med.kurume-u.ac.jp
広報に関するお問い合わせ先
久留米大学企画広報課
TEL: 0942-31-7510, FAX: 0942-31-7718
Mail: kikakukouhou@kurume-u.ac.jp
SAGA-LSに関するお問い合わせ先
公益財団法人佐賀県地域産業支援センター 九州シンクロトロン光研究センター
利用企画課
TEL: 0942-83-5017, FAX: 0942-83-5196
Mail: riyou@saga-ls.jp